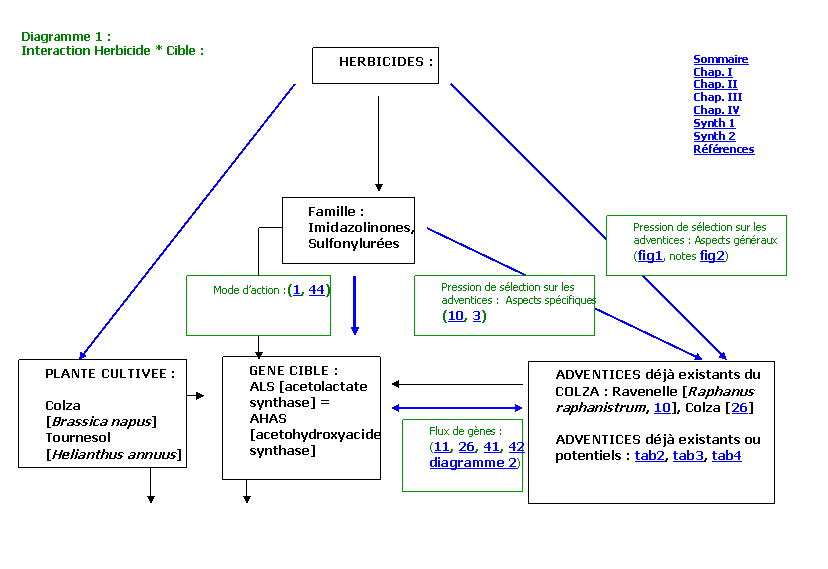
I.
Données biologiques à l’échelle de la
plante pour le système « Inhibiteur de l’ALS / AHAS » :
|
|

Plusieurs espèces végétales présentent des mécanismes de
détoxification des herbicides inhibiteurs de l’ ALS (soja, blé/certaines Sulfonylurées,
plusieurs graminées adventices 15, certaines crucifères 14 ). La mise en évidence de ces mécanismes a de fait rendu
possible l’émergence de cette famille. Cependant, son développement repose
aujourd’hui sur la régulation de l’interaction entre la molécule herbicide et
le gène cible.
I.1. Herbicides inhibiteurs de l’ « ALS»:
Fonction du gène cible, mode d’action des herbicides :[1]
I.1.a Le gène
cible :
L’enzyme acétolactate
synthase [ALS] plus souvent désigné par acétohydroxyacide synthase [AHAS, EC 2.2.1.6, EC 4.1.3.18] joue un rôle clef dans la synthèse des acides
aminés ramifiés [leucine, isoleucine, valine] et est la cible des herbicides du
groupe B (HRAC), en
particulier les Imidazolinones et Sulfonylurées.
I.1.b.
Mode d’action des herbicides inhibiteurs:
Une équipe australienne a analysé de façon détaillée le
mode d’action de cette famille [2, 33,
44]. Elle a analysé en structure tridimensionnelle le
complexe constitué entre l’enzyme AHAS chez Arabidopsis
Thaliana et les Sulfonylurées d’une part, les Imidazolinones d’autre part. Il
a été démontré que les modes d’action de ces deux sous-familles étaient
différents mais se recouvraient partiellement.
Nous retenons à ce stade qu’il est attendu que certaines mutations de
l’enzyme peuvent gêner l’intervention de l’herbicide tout en maintenant
l’activité de l’enzyme vis-à-vis de ce substrat. .
I.2. Variabilité génétique de l’ALS dans les espèces
cultivées et chez leurs adventices :
La principale exploitation de la variabilité génétique des
espèces cultivées réside aujourd’hui dans la valorisation de mutations
intervenant dans la séquence protéique de l’enzyme (par ex., Colza /mutagénèse
in vitro, Tournesol / écotype d’ Helianthus annuus sauvage). Ces mutations ont
ensuite rapidement été répertoriées chez les espèces adventices.
La position des mutations est référencée par rapport à la
séquence protéique de l’enzyme d’Arabidopsis
thaliana , et certaines d’entre elles sont retrouvées assez
systématiquement chez les génotypes présentant une tolérance soit aux Imidazolinones
(par ex. Ser653) , soit aux Sulfonylurées (par ex. Pro197), soit une tolérance croisées
aux deux familles d’herbicides (par ex. Trp574) [1]. On
trouvera dans la page mutations ALS
un recensement des mutations connues chez les espèces adventices par TRANEL et
WRIGHT (2002, 3). Le tableau 0 recense
l’ensemble des mutations soit observées chez les adventices, soit obtenues par
sélection dirigée dans les plantes cultivées, en 2002.
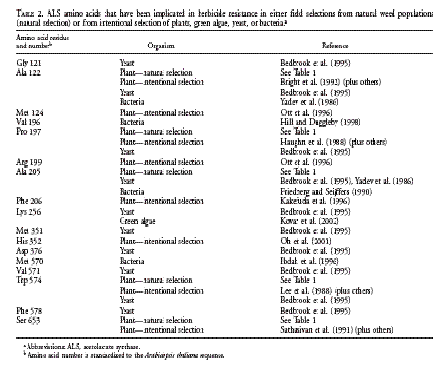
Tableau
0 : Mutations du gène AHAS conférant une résistance aux Imidazolinones ou
aux Sulfonylurées chez les adventices ou par sélection intentionnelle dans les
plantes cultivées :
Source :
TRANEL et WRIGHT, 2002
Dans l’idéal, une mutation conférant une tolérance à l’une
des familles mais pas à l’autre présenterait évidemment un intérêt pour le
management des adventices sur des cultures en rotation traitées avec l’une puis
l’autre des sous-familles du même groupe d’herbicides. Dans la pratique, les
modèles mis en œuvre par les firmes phytosanitaires « empilent »
généralement plusieurs mutations, soit parce que le niveau de tolérance obtenu
avec une mutation pourrait n’être pas suffisant même lorsque cette mutation est
présente à l’état homozygote (cas du Colza sur la mutation Ser653), soit parce le risque majeur
pris en compte est l’effet phytotoxique de l’herbicide sur la culture.
I.2.a : Création
par des approches non transgéniques de génotypes de COLZA [Brassica napus] et
de TOURNESOL [Helianthus annuus] :
Chez le Colza, des mutants ont été obtenus dès 1989 à
partir de culture de microspores [4,12],
et les mutations utilisées pour le développement de variétés tolérantes aux Imidazolinones
ont été identifiées (voir table 1). La firme BASF [*] qui a développé le concept
Clearfield ® sur canola considère que la mutation PM1 de la copie AHAS1 apporte 15%
de la résistance aux IMI, que la
mutation PM2 de la copie AHAS2 en apporte 85% , et que les deux
mutations doivent être développées à l’état homozygote [7].
Le développement d’hybrides de Colza d’hiver tolérants ces herbicides et
exploitant la stérilité mâle cytoplasmique est donc très lourd.
[*] BASF propose en fait [brevet 9]
l’association de trois familles d’herbicides : un inhibiteur de l’ALS, un
inhibiteur de la division cellulaire (métazachlore,chloroacétamide, Groupe K3/
HRAC) et alternativement une auxine synthétique (quinmerac, groupe O/HRAC ou un
inhibiteur de la synthèse des caroténoïdes (clomazone, groupe F3/HRAC). Le
brevet revendique un effet synergique permettant de combattre efficacement,
dans le canola, trois des adventices présent chez le colza en France : le
Géranium à tige grêle, le Sisymbre officinal et le Gaillet.
Chez le Tournesol, la tolérance d’écotype sauvage d’Helianthus annuus dans un champ de soja
traité aux Imidazolinones dans le Kansas a été exploitée en transférant cette
caractéristique dans le tournesol cultivé [5]. Il a été
montré que sur les 3 gènes AHAS identifiés, seul AHAS1, cartographié sur le
groupe de liaison 9, montrait un polymorphisme en relation avec la tolérance
aux herbicides [6]. Des outils de détection de ce
polymorphisme ont été développés à la fois pour les trois gènes, facilitant les
programmes de SAM mais aussi permettant un suivi prospectif du polymorphisme
dans les populations cultivées et sauvages. L’allèle mutant Ala205Val est considéré comme
semi-dominant, et les hybrides de tournesol développant le concept Clearfield ®
sont censés être homozygotes pour cet allèle [8] qui ne
confère une résistance acceptable qu’aux Imidazolinones et non aux Sulfonylurées.
Parmi les génotypes homozygotes pour la mutation, il semble y avoir une
variabilité pour la résistance aux Imidazolinones ; l’implication d’un
gène modificateur, non identifié à ce jour, a été supposée. Notons que l’USDA a
annoncé en janvier 2006 la diffusion des lignées HA442, résistance à Imazamox
et à forte teneur en acide oléique, et RHA 443, également résistante à cet
herbicide et intégrant une résistance à Plasmopara
halstedii provenant de Helianthus argophyllus via RHA419.
A la différence du système Clearfield ®, la famille de
brevets déposés par DU PONT [38] revendique une résistance
aux Sulfonylurées pour des génotypes de tournesol obtenus par mutation au MSE
et sélectionnés en présence de cette famille d’herbicides. L’objectif est
clairement de disposer d’une méthode de lutte contre les espèces du parasite Orobanche . Cette famille de brevets
s’appuie sur le dépôt de différentes lignées obtenues par cette méthode par
PIONEER. Elle ne fait pas référence à une mutation particulière de la séquence
du gène AHAS. La mutation est décrite
comme « particulièrement héritable », sans qu’il soit clairement
tranché entre la dominance ou la semi - dominance (i.e. l’additivité,
c'est-à-dire dans la pratique la nécessité de construire un génotype homozygote
pour le caractère afin de disposer d’un niveau acceptable de tolérance), sauf
peut-être vis-à-vis du metsulfuron-methyl. Il semble que les mutants obtenus soient
particulièrement résistants à certaines des Sulfonylurées (metsulfuron-methyl,
tribenuron-methyl, ethametsulfuron-methyl) , mais que le niveau de résistance à
l’Imazethapyr (IMI) soit supérieur à celui obtenu pour d’autres Sulfonylurées.
A ce stade, nous serions tentés de penser qu’il s’agit d’une résistance croisée
aux deux familles. Par ailleurs, comme la mutation Pro197Leu,
déjà trouvée chez le Tournesol, confère ce type de comportement, il nous
apparaît vraisemblable que la solution préconisée par ce brevet ne permette pas
de disposer des Imidazolinones comme recours pour combattre des adventices qui
auraient intégré le mécanisme de résistance proposé.
Notons également l’existence de la famille de brevets de
SYNGENTA [43] . La première publication disponible
date de 2003, et nous avons plus particulièrement consulté la publication
américaine de 2005. Ce brevet argue que les mécanismes de la résistance aux Imidazolinones
conférée par les mutants d’origine ANN_PUR (voir table 1)
n’est pas connue, ce qui ne nous semble plus être le cas aujourd’hui. Il
délivre l’information sur une mutation déclarée comme nouvelle dans la séquence
du gène AHAS, qui confèrerait la résistance aux Imidazolinones. A ce jour,
cette référence bibliographique nous pose problème, car nous n’avons pas réussi
à la relier aux autres données scientifiques disponibles. Un travail spécifique
serait nécessaire pour approfondir la question.
Enfin, a été publié en mars 2006 un brevet détenu par BASF
et ADVANTA [45]. Il y est décrit une mutation dans la grande sous-unité de
l’enzyme AHAS, dont nous déduisons du texte qu’il s’agit de Pro197Leu (nomenclature Arabidopsis), par comparaison avec la
référence décrite pour la mutation obtenue dans IMISUN-1. Il s’agirait donc de
la même mutation que celle obtenue dans SURES-1. Cette mutation serait présente
dans la lignée MUT28,
génotype dont nous supposons qu’il a été obtenu par ADVANTA. L’utilisation de
cette lignée comme « donneur » dans un programme de conversion y est
revendiquée aussi bien que l’utilisation de ces résultats en transformation
génétique. Il semble cependant que la tolérance aux Imidazolinones soit moins bonne
que celle de IMISUN-1, et que la tolérance aux Sulfonylurées soit bonne que
celle de SURES-1 (pages 67 à 69 du texte du brevet).

Table
1 : les mutations exploitées pour la résistance aux inhibiteurs de l’ALS
chez le Colza et le Tournesol
I.2.b :
Utilisation en transgénèse :
·
Comme
gène marqueur au cours du processus de transformation :
Il a été démontré que la transformation génétique de Brassica juncea peut être réalisée efficacement en utilisant un allèle d’AHAS conférant
la résistance à une Sulfonylurée (chlorsulfuron) ou à une Imidazolinone (imazethapyr
) comme marqueur de transformation [17].
·
Comme
gène marqueur et comme gène d’ « interêt » :
Le brevet WO0182685[16] de la société BASF revendique l’utilisation d’une
séquence du gène AHAS à la fois comme marqueur de sélection et comme gène
d’intérêt chez des monocotylédones (Maïs, Riz, blé).
·
Comme
gène d’intérêt :
Différents brevets ont été déposés dans ce domaine :
o
WO2004062351 (07/2004, 24) :
Ce brevet de VIRGINIA TECH INTELL PROP revendique la résistance croisée,
vis-à-vis de tous les herbicides du groupe 2, d’une mutation intervenant dans
un domaine conservé du gène AHAS.
o
WO2006007373
(01/2006, 25) : Déposé par BASF, ce brevet décrit notamment les séquences
des gènes AHASL1A, AHASL1B, AHASL1D qui confèreraient chez le blé une
résistance aux Imidazolinones, et impliquant une mutation à la position Ser653. Les revendications portent sur
d’autres espèces telles que le Colza et le Tournesol.
o
En
relation avec ce qui est exposé ci-dessus, les brevets US2005112571 (05/2005, 43) de SYNGENTA et
WO2006024351 (03/2006, 45)
de BASF-ADVANTA.
I.2.c : Adventices
sauvages du COLZA et du TOURNESOL résistants aux inhibiteurs de l’ALS : Etat
des lieux :
Ce sujet peut être abordé sous deux angles : On peut
d’une part examiner le statut des adventices des deux espèces cultivées dans le
système de culture actuel : cette approche présente une faiblesse majeure
dans la mesure où on peut s’attendre à ce que les populations d’adventices
évoluent rapidement sous la pression d’un système de culture nouveau. On peut d’autre
part analyser les connaissances acquises sur toutes les espèces adventices vis
à vis de leur résistance à cette famille d’herbicide pour appréhender le risque
de leur développement dans nos conditions agronomiques.
·
Sur
les 182 espèces recensées le 3 mars 2006 sur le site http://www.weedscience.org, 93 expriment
une résistance aux inhibiteurs de l’ALS : cette famille d’herbicide est
clairement et depuis longtemps celle pour laquelle le plus de mutants ont été
observés.(figure 1).
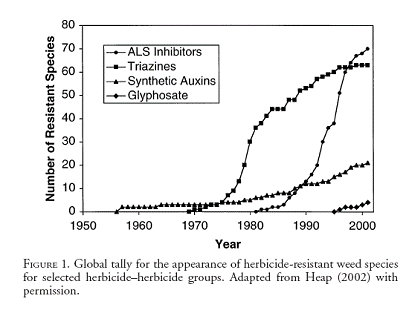
Figure
1 : Evolution du nombre d’espèces résistantes à quatre familles
d’herbicides. Source : TRANEL et WRIGHT 2002 [13]
Plusieurs de ces espèces ne sont cependant ni natives
d’Europe, ni présentes en Europe comme adventices des espèces cultivées. A
partir du site précédent, nous avons donc recensé leur statut dans la page Adventices_ALS, en précisant leur famille
botanique, s’il s’agissait de mono- ou dicotylédones, et si elles étaient
répertoriées sur le site www.dijon.inra.fr/hyppa. Sur les 40 espèces répertoriées sur
le site HYPPA, seules 9 (5 dicotylédones, 4 monocotylédones) ont été détectées
résistantes en Europe (au sens large) :
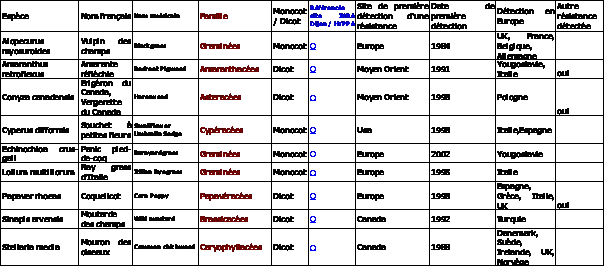
.
Table 2 :
Espèces adventices du Colza présentes en Europe et sur lesquelles une
résistance aux inhibiteurs de l’ALS a été détectée en Europe : Sources :
http://www.weedscience.org, www.dijon.inra.fr/hyppa
Pour un certain nombre de ces espèces, les mutations du
gène ont été identifiées [3].(donner quelques détails à ce niveau)
On notera que dans ce tableau, Helianthus annuus ne figure pas comme espèce sauvage recensée comme
résistante en Europe. Cependant, bien qu’elle ne soit pas native sur ce
territoire, la présence d’écotypes sauvages y aurait été enregistrée [RIESEBERG,
cité par FAURE et al, 2002], en particulier en Espagne et
en Italie : Il serait donc probablement nécessaire de considérer
l’ensemble des espèces adaptées à nos conditions agronomiques et sur lesquelles
une résistance a été répertoriée dans le monde, et pas seulement celles sur
lesquelles une résistance a été déjà répertoriée en Europe.
·
La
table 3 recense les cas de résistance aux inhibiteurs de
l’ALS pour les adventices importantes du Colza en France. A ce jour, on ne
trouve pas trace de résistance à cette famille d’herbicides au sein des
différentes espèces de Geranium : ce point nous a été confirmé après
échange d’e-mail avec P.TRANEL. Parmi les crucifères, la Ravenelle est la plus
concernée [10]. Dans le tableau de synthèse élaboré par
TRANEL et al [3], quatre des cinq mutations répertoriées
dans cette espèce sont situées au même
emplacement dans la séquence protéique (position Pro197),
et ont comme conséquence une résistance aux Sulfonylurées mais non aux Imidazolinones.
Selon TAN et MEDD [10], la mutation Trp574Leu
confère cependant une résistances à tous les herbicides du groupe B.
Des résistances ont également été trouvées chez la Sanve et
le Rapistre, mais les mutations en jeu ne sont pas identifiées.

Table 3 :
Résistances recensées chez les adventices principaux du Colza d’hiver en
France:
·
Sur
le Tournesol, nous avons plus particulièrement examiné le statut des espèces
adventices dicotylédones présentes en France et posant déjà des problèmes en
culture (Table 4) . Les Amarantes et Xanthium
strumarium présentent d’ores et déjà des mutations connues sur le gène
AHAS, qui leur confèrent une résistance aux Imidazolinones, aux Sulfonylurées
ou aux deux sous-familles d’herbicide. Notons que sur d’autres espèces
d’Amarante non répertoriées en France, des résistances et les mutations
associées ont été également signalées. Concernant le Chardon
des champs (Cirsium arvense), l’absence
de résistance connue aux inhibiteurs de l’AHAS nous a été confirmé par
P.TRANEL ; ce chercheur indique que le mode de reproduction de cette
espèce vivace à rhizome pourrait expliquer ce fait : A notre connaissance,
cette espèce diffuse également des semences. Il sera sans doute utile de
préciser l’efficacité des herbicides sur ce type de plante.

Table 4 : Statut
d’espèces adventices répertoriées en France et significatives en culture du
Tournesol vis-à-vis des herbicides inhibiteurs de l’AHAS : Source CETIOM + TRANEL et
WRIGHT(2002)
·
Comme
nous le soulignions en début de ce paragraphe, la notion d’ « adventices
importantes » est évidemment toute relative : les espèces prises en
compte dans le tableau 2 se sont développées dans le cadre des programmes de
désherbage pratiqués jusqu’à ce jour et en l’absence de variétés de colza
développant une résistance spécifique à une famille d’herbicides. La question
se pose de savoir ce que deviendront les équilibres de populations dans un
nouveau système, pour les dicotylédones, mais également pour les graminées
adventices ou cultivées : En effet, au-delà des tolérances aux Sulfonylurées
par détoxification de l’herbicide qui existent chez le blé [23]
comme chez d’autres graminées adventices, des résistances aux Imidazolinones
ont été développées chez le blé (19,20,
25, Clearfield
® wheat).
En conclusion, le génome des espèces cultivées et
adventices est doté d’une très grande plasticité vis-à-vis des herbicides
inhibiteurs de l’ALS, et le développement de cette famille d’herbicide sera
accompagné de l’apparition d’un nombre croissant de cas d’adventices résistants. Si une veille devait être mise en place, les Brassicacées, les
Amaranthacées, et les Astéracées devraient sans doute être les premières
familles à surveiller. Il sera également nécessaire de préciser le comportement
des Geranium et des chardons vis-à-vis des inhibiteurs de l’AHAS.
II.
Dynamique du développement des biotypes résistants
aux herbicides :
II.1. Coût adaptatif de la résistance aux herbicides :
Dans ce paragraphe sont évoqués les conséquences directes –
i.e. hors celles du flux de gènes allant de la plante cultivée vers les
adventices - de la pression de sélection exercée par les herbicides sur les
populations d’adventices.
La dynamique du développement d’écotypes d’adventices
résistants aux herbicides dépend notamment du handicap vs. de l’avantage
conféré à ces écotypes par le gène de résistance en absence vs. en présence de
pression de sélection exercée par l’herbicide [13]. Il a
été ainsi démontré que la tolérance au glyphosate apparue sur Ipomea purpurea était associée à un coût
adaptatif significatif, en absence de l’herbicide, de nature à permettre une lImitation
de son développement dès lors que les pratiques de désherbage étaient
correctement raisonnées [notes complémentaires, fig 2].
Sur ce point, on dispose de résultats de différente nature
concernant la résistance aux inhibiteurs de l’AHAS: Sauf dans un cas (BERGELSEN
et al., cité par 13) ] , aucun désavantage sélectif
significatif d’un allèle de résistance en absence de pression de sélection n’est
mis clairement en évidence. Parmi les études récentes figurent celles réalisées
sur Arabidopsis thaliana et sur le
gène csr1-1 associé une mutation Ser
au site Pro197 [22]
.Deux approches méthodologiques différentes ont été utilisées pour mesurer le coût
adaptatif associé à l’allèle de résistance : Lorsque ce coût est évalué à
partir de la première génération d’autofécondation d’un hybride hétérozygote
résistant/sensible, il ressort à 37% sur le caractère « nombre de
descendants ». Cependant, lorsque le coût est évalué sur plusieurs
générations, il ne diffère pas significativement de zéro. Les auteurs
soulignent l’importance des effectifs à manipuler pour disposer d’une bonne
puissance de détection ; cependant dans la même expérience, des coûts adaptatifs
significatifs sont mis en évidence pour des allèles conférant des résistances à
d’autre types d’herbicide.
On ne dispose pas de résultats obtenus par une démarche du
même type sur les espèces concernées par cette étude (Colza, Tournesol, et
leurs adventices). Toutefois, à ce jour, aucune différence significative n’a
été relevée dans des comparaisons de variétés quasi-isogéniques
sensible/résistante. Même s’ il existe plusieurs sites de mutation et que les
données pourraient différer sensiblement selon l’allèle de résistance exploité,
nous retenons à ce stade que la résistance aux inhibiteurs de l’AHAS provenant
de mutations dans sa séquence n’est pas associée à un désavantage sélectif.
En conclusion, à ce jour, il ne peut raisonnablement être attendu des mécanismes de résistance mis
en jeu aucune diminution de la fréquence des allèles de résistance en absence de pression de sélection de
l’herbicide.
II.2. Conséquences du flux de gènes du colza cultivé vers les
populations d’adventice :
Notre analyse prélIminaire repose
essentiellement sur la revue de A.LEGERE [26, voir aussi 11].
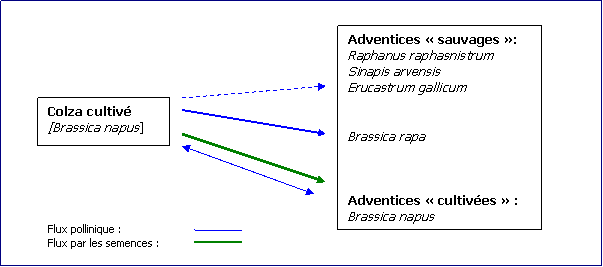
Nous retiendrons à cette étape les
principales conclusions suivantes :
·
La
fréquence des croisements au champ entre le colza et les espèces sauvages Raphanus raphanistrum, Sinapis arvensis et Erucastrum gallicum est suffisamment faible (10-8 à 3.10-5)
pour que le flux pollinique entre la plante cultivée et ces adventices ne soit
pas à considérer comme le facteur majeur de développement de populations
adventices résistantes.
·
Les
croisements entre le colza et Brassica
rapa sont potentiellement plus fréquents, mais Brassica rapa n’est pas à moyen terme une espèce potentiellement adventice
du colza dans nos contrées.
·
Les
pertes importantes, à la récolte du colza, dues à l’égrenage, qui conduisent à
constituer un stock dans le sol parfois
supérieur de vingt fois à l’ensemencement agricole, ainsi que les phénomènes de
dormance secondaire, contribueront
certainement à mettre en place la source la plus importante de création d’une
population adventice difficile à combattre. Cette population pourra de plus
être enrichie en allèles de résistance par un flux pollinique en provenance des
colzas cultivés. Dans un scénario où se développeraient en Europe différents
systèmes de contrôle des adventices [couple variété résistante / herbicide],
les résistances croisées se développeraient certainement au sein de cette
population, comme cela a été le cas au Canada [glyphosate + glufosinate,
glyphosate + imazethapyr, glyphosate + glufosinate + imazethapyr, 29] et en Australie. En retour, cette population adventice
est susceptible d’introduire des allèles de résistance au cours du processus de
production des semences commerciales, mais surtout d’enrichir leur fréquence de
façon non désirée dans les champs ensemencés avec des graines de ferme.
·
“ In summary, gene/transgene flow between canola varities […] and its
volunteers, and its relative B. rapa, is
currently inevitable ” [26].
En conclusion, à la question de savoir si le développement
de variétés de colza résistantes aux inhibiteurs de l’AHAS conduira à
l’apparition de populations adventices posant des problèmes aux agriculteurs,
la réponse est OUI. Il est également vraisemblable que quantitativement et à
moyen terme, la difficulté majeure provienne des colzas adventices.
II.3. Un flux de gènes du tournesol cultivé vers des populations
adventices d’ Helianthus annuus
sauvage ?
Plusieurs espèces du genre Helianthus sont des adventices importants sur le continent
nord-américain dont elles sont natives. Sur ce territoire, le flux de gènes
entre le Tournesol cultivé et les Helianthus sauvages est très documenté [35, 37, 41]. Il pourrait
également se développer des populations d’adventices à partir des descendances
de Tournesol cultivé. Bien que cela n’ait pas été constaté jusqu’à ce jour [34], ces populations sont susceptibles de constituer un pont
supplémentaire pour transférer les allèles portés par les variétés vers les
écotypes sauvages [42]. On peut estimer que pour ce
territoire et pour cette espèce, un flux de gène entre les types cultivés et
les populations adventices de toute nature – d’origine sauvage ou cultivée –
est encore plus certain que dans le cas du Colza. Dans le même temps, la
pression de sélection exercée directement par les herbicides sur les populations
sauvages a déjà fait émerger des résistances en leur sein, et suffit à elle - seule
à poser la question de leur gestion.
La situation en Europe pose a priori moins de questions. FAURE et al (2002) discutent les possibilités de transfert
d’allèle, en Europe, de variétés cultivées vers les espèces sauvages, en
particulier les espèces pérennes qui y sont présentes (par exemple H.tuberosus, topinambour) mais cette
étude n’apporte pas de données expérimentales démontrant que l’ Europe – au
sens large – est confrontée à la même difficulté que le continent nord –
américain.
En conclusion, le statut du genre Helianthus en Europe rend
peu probable sur ce territoire l’émergence d’une population d’adventices
résistants du même genre.
III.
Approches globales : Expériences de
terrain et modélisations:
III.1. Les
expériences canadiennes et autraliennes :
III.1.a :
Canada :
Le Canada a vu sa surface cultivée en canola doubler entre
1990 et 2004, à près de 5 millions d’hectares. Durant cette période, les
agriculteurs ont progressivement adopté la culture de canola résistants aux
herbicides (Round Up ®, Liberty ®, Clearfield ®) et on considère que 90% des
surfaces de « prairies » y ont recours. Le canola adventice est
devenu une préoccupation importante, et le blé adventice est en présence
croissante [28, 29].
Comme il existe des solutions pour combattre les canolas
adventices dans les cultures de céréales, soit en pré-semis (par exemple
Glyphosate) soit en culture (par exemple 2-4D), alors qu’il n’en existe pas en
culture pour plusieurs dicotylédones cultivées, les collègues canadiens
soulignent l’intérêt des rotations céréales/canola.
Ils considèrent également que des solutions existent pour
combattre les céréales adventices dans le colza au travers d’herbicides du
groupe A (inhibition de l’ACCase) en culture. Cependant, certains cas de
résistance croisée de monocotylédones adventices des céréales aux inhibiteurs
de l’AHAS et de l’ACCase ont été rapportés (Vulpia
bromoides [15], Lolium
rigidum [31])
S’agissant du Tournesol, on peut consulter le document
officiel canadien autorisant la culture d’un hybride X81359,
de BASF, résistant aux Imidazolinones [34] . L’Agence
canadienne estime que la constitution d’un stock d’adventices cultivés est peu
probable ; qu’en revanche le transfert de la résistance des variétés vers
les écotypes sauvages est très probable, mais que cette résistance y est déjà
présente. Elle considère que l’utilisation de solutions complémentaires mécanique
ou chImique ainsi que le respect des recommandations de la firme BASF doivent
permettre d’éviter les principales difficultés. Il s’agit cependant davantage
de « bonnes pratiques » que de solutions spécifiques.
III.1.b:
Australie :
Ce pays a été confronté rapidement aux problèmes de gestion
des adventices et développe une activité importante dans les domaines scientifique
et technique, couvrant aussi bien l’analyse des mécanismes de résistance que
les préconisations de conduite de culture et l’acceptabilité des nouvelles
technologies : Par exemple, la WHARI
(Western Australian Herbicide
Resistance Initiative) a organisé son activité pluridisciplinaire autour
du management des adventices en tant que tels, et non autour du management des
adventices dans les cultures. Ainsi, un modèle décisionnel de pratiques
agricoles (RIM = Resistance and Integrated Management, 32)
a été élaboré sur le management de Lolium
rigidum , puis également de Raphanus
raphanistrum, deux adventices majeurs des céréales et du colza.
Les solutions préconisées ou en cours d’élaboration ne
sont/seront certainement pas applicables en l’état. Mais ce type de démarche
peut probablement servir de modèle à ce qu’il conviendrait d’élaborer en Europe
pour aborder des problématiques aussi globales.
III.2. En Europe :
III.2.1. Colza de
printemps / Finlande [27]:
L’application de l’herbicide Imazamox sur des variétés de
colza de printemps IMI résistantes montre une bonne efficacité sur des
adventices importantes dans ce pays( Chenopodium album
et Galium spurium – peu significatives en France sur colza d’hiver – et
un gain de productivité significatif dans les situations où la pression de ces
adventices est importante.
III.2.2. Tentatives
d’approches globales en France :
Nous avons pris connaissance d’un projet intitulé « Méthodes et outils pour l’aide à la décision de la lutte contre les
adventices des cultures » déposé en réponse à l’appel d’offre
ADAR de 2005. Nous ne savons pas si ce projet a été retenu, mais il nous semble
que ce type d’approche pluridisciplinaire et transversale, au sens où il ne
s’agit pas seulement de répondre à une préoccupation sur une espèce cultivée,
devrait être encouragée et amplifiée.
La sous-action 1.2 pourrait ainsi être enrichie par un
inventaire, pour un certain nombre d’espèces adventices, du polymorphisme
génétique existant – situation de « départs » - vis-à-vis des gènes
AHAS impliqués dans le mécanisme de résistance à une famille d’herbicides en
passe d’être de plus en plus largement utilisée. Plus généralement, la
pérennisation d’un rassemblement de compétences diverses, à l’image de ce qui
s’est fait en Australie, serait certainement profitable.
IV.
Synthèse [provisoire] : Questions –
Réponses :
Nous partons dans ce chapitre, à la lueur des éléments
recueillis dans le domaine des sciences « dures » comme dans celui
des démarches agronomiques intégratives, de l’hypothèse que quelque soit
l’orientation prise par rapport à la question posée, il sera primordial de
communiquer de façon efficace vis-à-vis des acteurs concernés. Nous proposons
donc une série de questions / réponses dont nous pensons qu’elle peut éclairer
la prise de décision. Les questions ne couvrent pas tout le domaine, et
certaines se recouvrent. Soulignons bien sûr que nous n’avons pas la prétention
de dicter les réponses, mais de fournir de façon indirecte un élément d’appréciation
sur le niveau de maturation du sujet.
IV.1. Si on cultive du colza ou du
tournesol résistant aux Imidazolinones, verra t’on apparaître des adventices
résistants à ces produits chImiques ?
Oui, il est
pratiquement certain que cette technologie ne règlera pas à elle seule le
problème de la présence nuisible d’adventices pour la culture. Il pourra
s’agir d’adventices « sauvages », pour lesquelles on a déjà identifié
une capacité d’adaptation. Mais il faudra aussi se préoccuper des espèces
cultivées, car il est possible aujourd’hui de développer des résistances à
cette famille d’herbicides chez le blé, par exemple, sans parler du colza qui
peut devenir l’adventice le plus problématique, comme c’est déjà le cas au
Canada.
IV.2. Quelle différence y a-t-il entre
les colzas transgéniques résistantes au Round Up ® et les colzas résistantes
aux Imidazolinones ?
Il y a des
différences et des ressemblances :
·
Les plantes résistantes aux Imidazolinones
ont été obtenues par des voies traditionnelles de sélection consistant à sélectionner
des plantes résistantes –des mutants - au sein d’une large population soumise à
un agent mutagène puis à l’application du produit chImique. On a ainsi exploité
la capacité d’évolution d’un gène naturellement présent dans le règne végétal. Les plantes
résistantes au glyphosate ont fait l’objet d’un processus d’intégration dans
leur génome, par transgénèse, d’une construction génétique entièrement
originale pour l’espèce.
·
Dans les deux cas, on est cependant
confronté au même problème, lié à la capacité d’évolution des populations
naturelles : celui de l’apparition de plantes résistantes. De fait, ont
été observés des spécimen, assez rares, résistants au Round Up ® , et en plus
grand nombre des spécimen résistants à différents herbicides de la même classe
que les Imidazolinones.
IV.3. Si je cultive du colza ou du
tournesol résistant aux Imidazolinones, suffira t’il que je traite avec une
seule molécule de ce type ?
Non,
vraisemblablement pas, car certaines espèces adventices ont déjà la capacité à
y résister. Dans la pratique, il est
déjà envisagé, par la firme
BASF par exemple, d’associer trois molécules ayant des modes
d’action différents.
IV.4. De quel type de données dispose
t’on sur la nouvelle technologie de désherbage qui est proposée pour le colza et
pour le tournesol ?
Les Sulfonylurées et
les Imidazolinones sont des herbicides utilisés depuis longtemps. De ce fait,
les connaissances se sont accumulées tant sur le plan des pratiques agricoles
que sur celui des connaissances scientifiques. Il existe en fait deux types de
mécanismes de résistance des plantes à cette famille d’herbicides : d’une
part, ceux qui permettent à la plante de d’élIminer l’herbicide avant qu’il
n’ait un effet négatif sur le développement de la plante (cas du soja), d’autre
part ceux qui empêchent l’herbicide de se lier à un enzyme indispensable pour
la synthèse d’acides aminés importants pour la vie de la plante en le privant
ainsi de son efficacité. La technologie proposée aujourd’hui fait appel au
deuxième type de mécanisme. L’enzyme « cible » concerné est de mieux en mieux connu par les
physiologistes, et on est par exemple capable de prévoir, en analysant sa
séquence, si une espèce cultivée ou une espèce adventice peut se révéler
résistante. Dans le même temps, on sait d’ores et déjà que des adventices sont
résistantes. La question est donc de savoir si l’on est capable collectivement
de valoriser les connaissances acquises pour définir un « mode
d’emploi » efficace sur le court et long terme.
IV.5. On parle globalement de la famille
herbicide des inhibiteurs de l’ALS : y a-t-il des différences entre les Imidazolinones
et les Sulfonylurées ?
Si ces deux
sous-familles agissent directement sur l’enzyme ALS, on sait maintenant en
quoi leurs modes d’action sont
différents, et également en quoi ils se recouvrent partiellement. La nature de
la mutation portée par les cultivars résistants, qui est en général entièrement
décrite au niveau de la séquence nucléique et protéique de l’enzyme, peut
conduire soit à une résistance aux Imidazolinones comme aux Sulfonylurées, soit
à l’un seul de ces deux types de molécules. On observe bien sûr également des
niveaux d’action différents sur les adventices. Dans le schéma Clearfield ®
proposé par BASF, les mutations développées sur Colza et sur Tournesol
confèrent une résistance particulière aux Imidazolinones. DuPont a focalisé son
schéma sur la résistance aux Sulfonylurées. En terme de conséquences sur
l’évolution de la flore adventice, il apparaît cependant vraisemblable que des
pressions de sélection voisines seront mises en œuvre que l’une ou l’autre des
familles soit développée.
IV.6. Vis-à-vis de cette problématique,
qu’est ce qui distingue le Colza et le Tournesol ?
On peut identifier
aujourd’hui deux différences principales : La diffusion du progrès
génétique sur les critères de sélection habituels du Colza sera, toutes choses
égales par ailleurs, plus lente qu’en Tournesol, car deux gènes doivent être
présents chez les parents – dans le système Cleafield ® - pour assurer selon la firme BASF le niveau de
résistance suffisant. Par ailleurs, on peut s’attendre à ce qu’en Europe, les
difficultés de gestion des populations adventices apparaissent plus rapidement
sur Colza, du fait des repousses de colza.
V.
Synthèse générale :
Le génome des espèces cultivées et adventices est doté
d’une très grande plasticité vis-à-vis des herbicides inhibiteurs de l’AHAS, et
le développement de cette famille d’herbicide sera accompagné de l’apparition
d’un nombre croissant de cas d’adventices résistants.
Il ne semble pas que soient associés aux allèles de
résistances des effets défavorables tels que leur fréquence diminuerait en
absence de pression de sélection de l’herbicide. Les allèles sélectionnés par
l’utilisation de l’herbicide se maintiendront donc dans les populations
naturelles.
Le développement de variétés de colza ou de tournesol résistantes
au inhibiteurs de l’AHAS conduira à l’apparition de populations adventices
posant des problèmes aux agriculteurs. Il est également vraisemblable que
quantitativement et à moyen terme, la difficulté majeure pour la zone de
culture du colza provienne des colzas adventices. Pour le tournesol, le statut
du genre Helianthus en Europe rend peu probable sur ce territoire l’émergence
d’une population d’adventices résistants du même genre, mais il sera important
de surveiller l’évolution de populations naturelles de la même famille
[Astéracées] dont on sait déjà qu’elle présente un polymorphisme pour le gène
concerné.
On pourrait donc être tenté de considérer le développement
des variétés de colza ou de tournesol résistantes à cette famille d’herbicides
avec beaucoup de prudence, d’autant que cette technologie se développe sur la
majorité des espèces de grande culture. Dans le même temps, parce que les
mécanismes en cause sont connus de plus en plus précisément, nous disposons
aujourd’hui d’outils de veille [moléculaire par exemple], et d’expériences
d’approches intégrées qui permettent d’imaginer comment le management des
adventices pourrait être organisé dans ce nouveau paysage.
VI.
REFERENCES :
[1] Imidazolinone-tolerant crops: history, current status and future.
TAN S., EVANS R.R., DAHMER M.L., SINGH B.K., SHANER D.L. Pest Manag Sci 61: 246-257 (2005). Full text
[2] Molecular basis of Sulfonylurea
herbicide inhibition of acetohydroxyacid synthase. PANG S.S., GUDDAT L.W.,
DUGGLEBY R.G. J Biol Chem 278:
7639-7644 (2003)
[3] ALS mutations from
herbicide-resistant weeds. TRANEL P.J., WRIGHT T.R, and HEAP I.M., Herbicide Resistant Weeds http://www.weedscience.com
[4] Microspore mutagenesis and
selection: canola plants with field tolerance to the Imidazolinones. SWANSON
E.B., HERRGESELL M.J., ARNOLDO M., SIPPELL D.W., WONG R.S.C. Theor Appl Genet 78: 525-530 (1989)
[5] Imazethapyr resistance in common
sunflower (Helianthus annuus) AL-KHATIB K., BAUMGARTNER J.R., PETERSON D.E.,
CURRIE R.S. Weed Sci 46: 403-407
(1998)
[6] Acetohydroxyacid synthase mutations
conferring resistance to Imidazolinone or Sulfonylurea herbicides in sunflower.
KOLKMAN J.M., SLABAUGH M.B., BRUNIARD J.M., BERRY S., BUSHMAN B.S., OLUNGU C.,
MAES N., ABRATTI G., ZAMBELLI A., MILLER J.F., LEON A., KNAPP S.J. Theor
Appl Genet 109(6):1147-1159 (2004)
[7]
COMPOSITIONS AND METHODS FOR IDENTIFYING PLANTS HAVING INCREASED TOLERANCE TO IMIDAZOLINONE
HERBICIDES. CHEUNG WING Y., GAGNON M.J., LAFOREST M., LANDRY
B.; Brevet WO2004040012
en ligne
(2004)
[8] Document de décision
DD2005-50 :Détermination du risque de l'hybride de tournesol (Helianthus annuus L.) X81359 CLEARFIELDMC
tolérant l'Imidazolinone de BASF Canada en
ligne
[9] SYNERGISTICALLY ACTING HERBICIDAL MIXTURES SIEVERNICH B., BRIX H.D., MALEFYT T., Brevet WO2005096814 en ligne (2005)
[10] Characterisation
of the acetolactate synthase (ALS) gene of Raphanus raphanistrum L. and the
molecular assay of mutations associated with herbicide resistance. TAN M.K.,
MEDD R.W., Plant Science, 163, 195-205 (2002)
[11] Hybridization between transgenic Brassica napus L. and its wild
relatives: Brassica rapa L., Raphanus raphanistrum L., Sinapis arvensis L., and
Erucastrum gallicum (Willd.) O.E. Schulz. WAEWICK
S.I., SIMARD M.J., LEGERE A., BECKIE H.J., BRAUN L., ZHU B., MASON P.,
SEGUIN-SWARTZ G., STEWART CN jr. Theor
Appl Genet 107(3):528-539 (2003)
[12] Isolation, expression
and phylogenetic inheritance of an acetolactate synthase gene from Brassica
napus. Mol Gen Genet 219(3): 413-420 (1989)
[13]
Resistance of weeds to ALS-inhibiting herbicides: what we
have learned? TRANEL P.J.,
WRIGHT T.R Weed Science 50:700–712 (2002)
[14] Metabolism-based
resistance of a wild mustard (Sinapis arvensis L.) biotype to
ethametsulfuron-methyl. VELHUIS L.J., HALL L.M., O’DONOVAN J.T., DYER W., HALL
J.C. J Agric Food Chem 48(7) 2986-2990
(2000)
[15] Tolerance
to acetolactate synthase and acetyl-coenzyme A carboxylase inhibiting
herbicides in Vulpia bromoides is conferred by two co-existing resistance
mechanisms. YU Q., SHANE FRIESEN L.J., ZHANG X.Q., POWLES S.B. Pesticide
Biochemistry and Physiology 78, 21-30 (2004)
[16] USE
OF THE MAIZE X112 MUTANT AHAS 2 GENE AND IMIDAZOLINONE HERBICIDES FOR SELECTION
OF TRANSGENIC MONOCOTS, MAIZE, RICE AND WHEAT PLANTS RESISTANT TO THE IMIDAZOLINONE
HERBICIDES. LOCHETTO C. Brevet WO0182685 en
ligne (2004)
[17]
Mutant acetolactate synthase gene is an efficient in vitro
selectable marker for the genetic transformation of Brassica juncea (oilseed
mustard). RAY K., JAGANNATH A., GANGWANI S.A.,
BURMA
P.K., PENTAL D. J Plant Physiol 161 (9) 1079-1083 (2004)
[18] BRASSICA AHAS GENES AND
GENE ALLELES THAT PROVIDE RESISTANCETO IMIDAZOLINONE HERBICIDES. LEIBEL
BRADLEY D., POTTS DEREK A., YAO KENING, MALES DARYL R., Brevet CA2507844, en
ligne, (2005)
[19] Tolerance
to Imidazolinone herbicides in wheat. NEWHOUSE K.E., SMITH W., STARRETT M.,
SCHAEFER T., STIDHAM M., Plant Physiol. 100:882-886 (1992).
[20] Physiological and molecular analysis characterization of
mutation-derived Imidazolinone resistance in spring wheat. POZNIAK C.J., BIRK
I.T., O’DONOUGHUE L.S., MENARD C., HUCL P.J., SINGH B.K., Crop Sci 44:
1434-1443 (2004)
[21] Fitness
costs and benefits of novel herbicide tolerance in a noxious weed. BAUCOM R.S.,
MAURICIO R., PNAS 101, 13386-13390 (2004)
[22]
Multigenerational versus single generation studies to
estimate herbicide resistance fitness cost in Arabidopsis thaliana. ROUX F.,
CAMILLERI C., BERARD A., REBOUD X. Evolution 59(10) 2264-2269 (2005).
[23] Basis
of Selectivity of the Herbicide Flupyrsulfuron-methyl in Wheat. KOEPPE M.K.,
BAREFOOT A.C., COTTERMAN C.D., ZIMMERMANN W.T., LEEP D.C. Pesticide
Biochemistry and Physiology 59 (2) 105-117 (1997)
[24] GENE
ENCODING RESISTANCE TO ACETOLACTATE SYNTHASE-INHIBITING HERBICIDES. WHALEY
C.M., WILSON H.P., WESTWOOD J.H. Brevet
WO2004062351 , en
ligne, (2004)
[25] POLYNUCLEOTIDES ENCODING MATURE AHASL PROTEINS FOR
CREATING IMIDAZOLINONE-TOLERANT PLANTS. BIRK
I., SINGH B., PARKER G., Brevet WO2006007373, en
ligne, (2006).
[26]
Risks and consequences of gene flow from herbicide-resistant
crops: Canola (Brassica napus L) as a
case study. LEGERE A. Pest Manag Sci 61: 292-300 (2005)
[27] Efficacy of imazamox in Imidazolinone-resistant spring oilseed rape in
Finland, HAUKKAPÄÄ A.L., JUNNILA S., ERIKSSON C., TUSISALO U., SEPPÄNEN L. , Agricultural
and Food science, 14 (4), 377-388 (2005)
[28] Ecology And Management Of Volunteer Canola, en
ligne (2005)
[29] Herbicide Resistance Management Issues In Plants
With Novel Traits (PNT’s), en ligne, (2002)
[30] Plant
Biotechnology : Potential Impact for Improving Pest
Management in European Agriculture. Wheat – herbicide-tolerant Case
Study. GIANESSI L., SANKULA S.,
REIGNER N., National
Center for Food and
Agriculture Policy. , en ligne,
(2003)
[31]
High survival frequencies at low herbicide use rates in
populations of Lolium rigidum result in rapid evolution of herbicide
resistance. NEVE P., POWLES S., Heredity 95(6) 485-492 (2005)
[32] RIM: A Bioeconomic Model for Integrated Weed
Management of Lolium rigidum in Western
Australia. PANNELL D.J., STEWART V., BENNETT A.,
MONJARDINO M., SCHMIDT C., POWLES S.B. Agricultural Systems 79(3):
305-325, en ligne,(2004)
[33]
Elucidating the
specificity of binding of Sulfonylurea herbicides to acetohydroxyacid synthase.
McCOURT J.A., PANG S.S., GUDDAT L.W., DUGGLEBY R.G. Biochemistry 44(7) 2330-2338 (2005)
[34]
Détermination du
risque de l'hybride de tournesol (Helianthus annuus L.) X81359 CLEARFIELDMC tolérant
l'Imidazolinone de BASF Canada en
ligne
[35]
Gene flow from Imidazolinone-Resistant Domesticated Sunflower
to Wild relatives.
[36]
Registration of Imidazolinone Herbicide-Resistant Mainteneer
(HA442) and fertility restorer (RHA442) Oilseed Sunflower Germplasms. ARS
Research Project, en
ligne.
[37]
Relative Fitness of
Imazamox-Resistant Common Sunflower and Prairie Sunflower. ARS Research
Project,
en ligne.
[38] SULFONYLUREA-TOLERANT SUNFLOWER PLANTS.
GABARD J., HUBY J.P., Brevet WO0165922 DU PONT en
ligne
[39]
Utilization of
Cross-Resistance to Create Herbicide-Resistant Sunflower Hybrids. ARS Research
project, en
ligne
[40] Potential
gene flow from cultivated sunflower to volunteer, wild Helianthus species in Europe. FAURE N., SERIEYS H., BERVILLE A., Agriculture,
Ecosystems & Environment 89 (3) :183:189 (2002).
[41] The potential for gene flow between cultivated and
wild sunflower (Helianthus annuus) in the United States. BURKE J.M., GARDNER K.A., RIESEBERG
L.H., American Journal of Botany 89: 1550-1552
(2002).
[42] Cultivated Helianthus
annuus (Asteraceae) volunteers as a genetic "bridge" to weedy
sunflower populations in North America. REAGON M., SNOW A.A.,
American Journal of Botany 93:127-133.(2006)
[43]
DNA MOLECULES CONFERRING TOLERANCE TO HERBICIDAL COMPOUNDS GIELEN
J., ANNES J.L., AZANZA F., Brevet US2005112571
SYNGENTA en ligne
[44]
Herbicide-binding sites revealed in the structure of plant
acetohydroxyacid synthase. McCOURT J.A., PANG S.S., KING-SCOTT
J., GUDDAT L.W., DUGGLEBY R.G. Proc Nat
Acad Sci USA
103 (3):569-573. (2006)
[45] HERBICIDE-RESISTANT
SUNFLOWER PLANTS, PLYNUCLEOTIDES ENCODING HERBICIDE-RESISTANT ACETOHYDROXY ACID
SYNTHASE LARGE SUBUNIT PROTEINS, AND METHODS OF USE. LEON A.J., MORATA M.M., ZAMBELLI A.
Brevet WO2006024351 BASF-ADVANTA
en
ligne
Notes et documents complémentaires:
Sommaire Diagramme Chap. I Chap. II Chap. III
Synth 1
Synth 2 Réferences
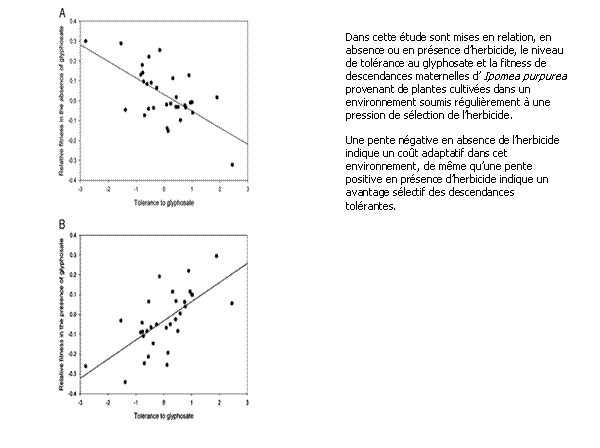
Figure 2 :
Illustration de l’avantage sélectif de l’adventice Ipomea purpurea (« Morning
Glory ») tolérant au glyphosate en absence ou en présence du présence de
l’herbicide. Source : BAUCOM R.S. et MAURICIO R, 2004, [21]
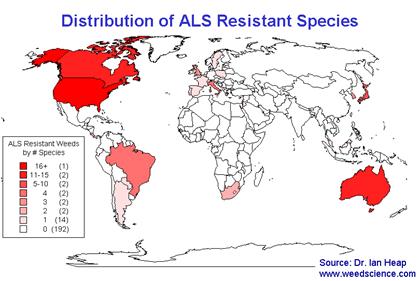
Figure 3 : Distribution des espèces résistantes aux inhibiteurs de l’ALS
dans le monde. http://www.weedscience.com